Al leer la palabra radioisótopo lo primero que se nos viene a la cabeza, probablemente es la radiación, que a su vez seguramente la relacionemos con algo peyorativo y con graves consecuencias para la salud humana y la de nuestro entorno. Por lo que ponerlo en la misma frase que “tratamiento contra el cáncer” quizá nos parezca un tanto contradictorio.
Para empezar, ¿Qué es un radioisótopo?
En términos generales, un radioisótopo o radionúclido es una forma inestable de un elemento. Un elemento químico podría ser definido por el número de protones que tiene en el núcleo, también denominado número atómico o Z, y su número de protones y neutrones, lo que se denomina número másico, A. Los isótopos de un elemento químico son aquellas formas que poseen un mismo número de protones o Z, pero difieren en el número másico. La forma de nombrarlos es AZX, siendo X el elemento en cuestión.
Como ejemplo, el hidrógeno tiene 3 isótopos conocidos: el propio, el deuterio y el tritio. Todos ellos, tienen el mismo número atómico, 1, es decir, tienen un protón y por ello son clasificados como hidrógeno, pero difieren en el número másico. El propio hidrógeno (11H) es el más abundante y no tiene neutrones, el deuterio (21H) posee un neutrón y el tirito (31H) dos neutrones.
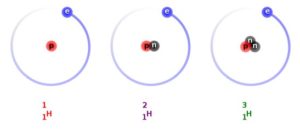
Imagen 1. Los tres isótopos conocidos de hidrógeno con sus respectivo protón (en rojo) y neutrones (gris).
Los isótopos de un elemento se pueden clasificar en dos grupos: isótopos estables e isótopos inestables o radioisótopos. En términos generales, un radioisótopo o un radionúclido, es una forma inestable de un elemento que libera radiación a medida que se descompone y se vuelve más estable. En el ejemplo anterior del hidrógeno, el tritio es un isótopo inestable por su balance entre neutrones y protones, por lo que está continuamente cambiando de forma, emitiendo radiación. Cada radioisótopo tiene su periodo de desintegración o vida media.
Efecto de la radiación en tus células
La radiación actúa en nuestras células dañando el ADN, la molécula que contiene toda la información necesaria (guardada en genes), para que cada célula crezca y desarrolle sus funciones. Si el DNA sufre daños considerables, la célula pierde su capacidad para crecer y dividirse, y con el tiempo, acaba muriendo. Esto ocurre porque antes de dividirse, la célula pasa unos controles de calidad en los que comprueba, entre otras cosas, si el DNA está en buenas condiciones, y si no es así, no se divide y disminuye su actividad hasta morirse.
La radiación provoca roturas en las dos cadenas o hebras del DNA (double strand breaks, DSBs) y cuando estos daños se detectan, la maquinaria de la célula que se ocupa de repararlo deteniendo el ciclo celular en uno de estos puntos de control. La capacidad de responder a los efectos de la radiación es proporcional a la capacidad de la célula de reparar su DNA dañado. Si la célula repara de forma eficaz los daños, el ciclo continúa, por lo que estas células serían resistentes a la radiación. Sin embargo si las células no consiguen reparar el DNA, el ciclo se estanca, para no transmitir esta información genética estropeada a las células hijas.
La radiación es especialmente dañina en células que se están dividiendo de forma activa, lo que incluye células cancerosas, pero también otras células sanas de nuestro organismo que tienen una tasa de división elevada, como las células de la piel o las de la médula ósea. Es por ello que la terapia con radioisotopos se ha centrado en dirigir estos compuestos radiactivos únicamente a las células cancerosas, aprovechándose de características que sólo ellas tienen. Con ese fin, se han conjugado radioisótopos con marcadores moleculares específicos de las células transformadas, que solamente están presentes en el tumor.
La palabra teranóstica (theranostics en inglés) se utiliza de forma recurrente en la medicina nuclear (aunque es aplicable a otras ramas de la biomedicina) para referirse a la identificación de las células cancerosas y su tratamiento usando moléculas radioactivas. La idea de la teranóstica es identificar de manera específica la diana molecular idónea para cada paciente, con el fin de maximizar el efecto del tratamiento y minimizar su toxicidad.
Los radioisótopos que se usan en la clínica para el diagnóstico y tratamiento de cáncer reciben el nombre de radiofármacos. Un radiofármaco está compuesto de tres partes:
- Radioisótopo con propiedades de diagnóstico y/o tratamiento
- Sonda molecular (péptidos, mAb)
- Agente quelante que une el radioisótopo con la sonda molecular
En los siguientes apartados se exponen algunos ejemplos del uso de radioisótopos en la actualidad para el tratamiento del cáncer.
Radioisótopos anti-cáncer
Yodo radiactivo para el cáncer de tiroides
El cáncer de tiroides es la enfermedad neuroendocrina más prevalente, y el uso del yodo radiactivo a mejorado considerablemente su diagnóstico y tratamiento. El radioyodo se utiliza tanto para cáncer de tiroides diferenciado y metástasis locales o a distancia, como para casos de hiperteroidismo.
De los primeros éxitos de la teranóstica con radioifármacos fue el Yodo-131 (131I, radioyodo) para tratar el cáncer y otras afecciones de tiroides, ya en los años cuarenta, y desde entonces el uso de radioisótopos para el diagnóstico y tratamiento del cáncer ha aumentado y evolucionado de forma considerable.
El radioyodo se utiliza como agente único, sin ningún tipo de sonda específica. Este tratamiento se aprovecha de la fisiología del tiroides, que usa yodo para producir las hormonas tiroideas. El yodo es absorbido de la sangre por las células foliculares del tiroides y éstas no son capaces de distinguir entre el yodo y el radioyodo, con lo que lo absorben igualmente. El requerimiento de yodo de la glándula tiroides es con creces superior al de cualquier otro tejido de nuestro organismo, pero esto no significa que este radioyodo no llegue a otras partes de nuestro cuerpo, con las consecuencias cancerígenas que puede tener. Es por ello que en los últimos años se esta analizando si los pacientes bajo tratamiento de radioyodo tienen más probabilidad de sufrir cualquier tipo de cáncer que la población general.
Con el fin de minimizar los efectos secundarios y maximizar la eficacia de los radioisótopos, en los últimos años se ha se han seguido diferentes estrategias para dirigir la radiactividad únicamente a las células malignas. Las estrategias que se mencionan a continuación para llegar a los marcadores moleculares de las células cancerosas están basadas en péptidos (pequeñas proteínas), análogos de hormonas y anticuerpos monoclonales (mAb).
Radioisótopos de receptores peptídicos (PRRT) para el tratamiento de tumores neuroendocrinos
Los tumores neuroendocrinos son un tipo de tumores raros, aunque su prevalencia está creciendo en los últimos años. Los más comunes son los tumores gastroenteropancreaticos y los tumores bronquiales. Se desarrollan en células neuroendocrinas, que poseen similitudes con células nerviosas y endocrinas o células secretoras de hormonas.
Un distintivo de estos tumores es que las células expresan en su parte externa el receptor de la somatostatina o SSR (somatostatin receptor). La somatostatina es una hormona que a su vez controla la secreción de otras hormonas como el glucagón, la insulina y la hormona del crecimiento. Una aproximación para el tratamiento de estos tumores es el uso de análogos de la somatostatina, moléculas de estructura y función parecida pero con mayor efecto farmacológico.
La aproximación terapéutica con radiofármacos para tumores neuroendocrinos se basa en la unión de éstos análogos de al somatostatina con radioisótopos como 77Lu, 90Y o 225Ac. A este tipo de terapia se le denomina terapia con radionucléidos con receptor de péptidos, PRRT. Los radioisótopos se unen mediante un quelante al análogo de la somatostatina, que con frecuencia es la octreotida.
Radioisótopos ligados a PSMA para el tratamiento de cáncer de próstata
El cáncer de próstata supone una de las principales causas de muerte asociadas a cáncer en hombres. La prostatectomía o extirpación de la glándula prostática y la radioterapia externa suelen ser los tratamientos más comunes, pero en casos de más alto riesgo y cuando existe metástasis pueden no ser suficientes.
El antígeno prostático específico de membrana (PSMA) es una proteína que se expresa con frecuencia en cáncer de próstata. El uso de 177Lu conjugado con PSMA-617 ha resultado ser más eficaz que la quimioterapia en pacientes con cáncer de próstata resistente a castración.
Además de el uso de radiofármacos para el tratamiento, el diagnóstico de cáncer de próstata ha progresado considerablemente gracias al uso de la tomografía por emisión de positrones (PET).
Análogos de la noradrenalina ligados a radioisótopos para el tratamiento de neuroblastoma
El neuroblastoma es el tumor más frecuente durante los dos primeros años de vida y el tumor extracraneal más frecuente en la infancia. Estos tumores nacen de células primitivas de la cresta neural y son muy diversos en cuanto a la localización, etiología y comportamientos clínicos, lo que supone un desafío en el tratamiento.
El 90% de los neuroblastomas sobreexpresan el receptor de noradrenalina. Este receptor esta sobreexpresado también en otros tumores que tienen su origen en la cresta neural, el feocromocitoma y el paraganglioma. Es por ello que una de las estrategias que se ha seguido para el tratamiento con radiofármacos de estos tumores es utilizar un análogo de la noradrenalina, la meta-iodo-bencil-guanidina (mIBG) marcada con 131I o 123I. El 131I-mIBG ha demostrado grandes efectos especialmente en los neuroblastomas que han sufrido recaídas o son resistentes.
Radioinmunoterapia
Los mAb son una forma muy específica de dirigir un fármaco concreto a una diana molecular específica, es por ello que el uso de mAb conjugados con radioisótopos (radioinmunoterapia) es una rama de la medicina personalizada muy prometedora. La radioinmunoterapia (RIT) se aplica en la actualidad a los tumores más sensibles a la radiación, los tumores hematológicos (los linfomas y las leucemias). Para tener una buena respuesta, los tumores sólidos necesitan aproximadamente 5-10 veces más radiación que los hematológicos. De igual manera, si el origen de las células tumorales es hematológico, aunque el cáncer no lo sea, éstas serán más radiosensibles.
Las dianas terapéuticas que se han testado incluyen CD20, CD22, HLA-DR, CD33 y CD45 para cánceres hematológicos y el PSMA para tumores sólidos.
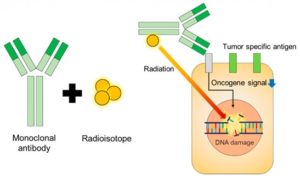
Figura 1. El uso de radioisótopos ligados a anticuerpos monoclonales (mAb) como radiofármacos. El radioisótopo es dirigido a las células cancerosas mediante el reconocimiento de marcadores tumorales específicos mediante el mAb. Esto provoca roturas en el DNA y hace que las señales de crecimiento celular disminuyan.
Conclusiones
El tratamiento de diferentes cánceres con radiofármacos es un campo prometedor en la medicina personalizada y su evolución va inexorablemente ligada al descubrimiento de nuevas dianas moleculares para cada tipo de cáncer. Cuanto más sepamos a cerca de cada tumor, más se podrán ajustar las sondas a cada paciente y más específicos serán los tratamientos, minimizando sus efectos secundarios. La especificidad es un aspecto muy importante en este tipo de tratamientos, ya que ciertas dosis de radiactividad en tejidos sanos podría desarrollar el efecto opuesto.
Para aumentar la efectividad, es necesario seguir investigando en diferentes radioisótopos, así como en los quelantes que los unen a sus respectivas sondas, ya que de ello en gran parte dependerá la internalización y la dosis de radiación que reciban las células cancerosas.
Cada tumor es único y así debe de ser su tratamiento. Un buen uso de la dosimetría, es decir la medición de radiación, para determinar la radiación absorbida por el tumor o los tejidos sanos del paciente es clave a la hora de obtener una eficacia y seguridad óptima durante el tratamiento. En el futuro podríamos hablar además de sondas específicas para cada tipo de tumor, de dosis de radiación y ciclos específicos individualizados para cada paciente.
Recomendamos:
- https://microbacterium.es/que-procesos-comunes-estan-implicados-en-el-cancer-patologia
- https://www.quimicaysociedad.org/la-isomeria-mismos-atomos-distintas-moleculas/
- https://microbacterium.es/la-reaccion-de-maillard-y-los-aromas-de-los-alimentos-cocinados
Este artículo ha sido redactado por el equipo de microbacterium.es de forma exclusiva para Foro Química Y Sociedad. Artículo redactado por Leire Torices Cabarcos y editado por Rodrigo Álvarez Monzón
Bibliografía
- Future of Theranostics: An Outlook on Precision Oncology in Nuclear Medicine. Thomas Langbein, Wolfgang A. Weber, and Matthias Eiber. Journal of Nuclear Medicine. 2019, 60 (Supplement 2) 13S-19S
- Cancer incidence and mortality following treatment of hyperthyroidism with radioactive iodine. Josh M Evron, Nazanene H Esfandiari, Maria Papaleontiou
- Indications of Peptide Receptor Radionuclide Therapy (PRRT) in Gastroenteropancreatic and Pulmonary Neuroendocrine Tumors: An Updated Review. Baptiste Camus, Anne-Ségolène Cottereau, Lola-Jade Palmieri, Solène Dermine, Florence Tenenbaum, Catherine Brezault, Romain Coriat. Journal of Clinical Medicine. 2021, 10(6):1267.
- A systematic review of 131I-meta iodobenzylguanidine molecular radiotherapy for neuroblastoma. Wilson JS, Gains JE, Moroz V, Wheatley K, Gaze MN. Eur J Cancer. 2014; 50: 801-15.
- Radioimmunotherapy of human tumours. Steven M. Larson, Jorge A. Carrasquillo, Nai-Kong V. Cheung, Oliver Press. Nat Rev Cancer. 2015, 15(6): 347–360.