Los investigadores están luchando para ponerse de acuerdo sobre las razones subyacentes de las tasas aceleradas y mecanismos de reacción alterados en los microgonds de agua. Esto es lo que sabemos y dónde están las preguntas abiertas…
¿Qué son las microgotas de agua?
Son justo cómo suenan: gotas de agua muy diminutas. Un microgota es unas 100 veces más pequeña que una gota de lluvia.
Las microgotas del agua son el foco de un debate científico. Los estudios sugieren que pueden acelerar las tasas de numerosas reacciones orgánicas en otros, hasta 10.000 veces, así como iniciar reacciones que no se producen en soluciones de agua a granel. Las implicaciones son de amplio alcance y se extienden desde la explicación de la química prebiótica hasta la mejora de la química sintética. Si los químicos pueden entenderlas mejor, y determinar cómo escalar las reacciones que los usan, las microgotas de agua podrían ayudar a los investigadores a evitar costosos catalizadores o altas temperaturas y presiones cuando se hacen numerosos productos químicos.
¿Cómo se generan las microgotas de agua?
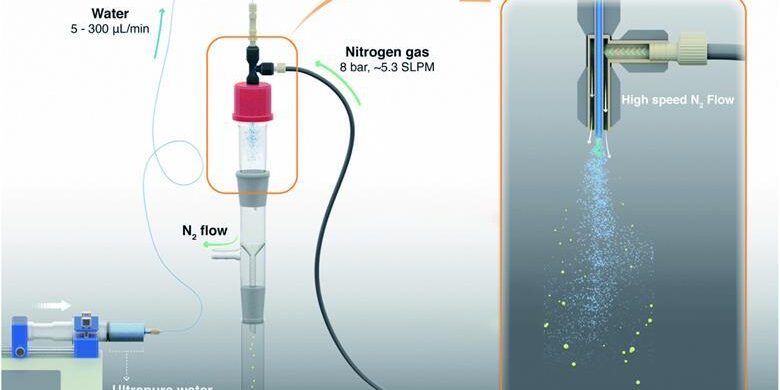
Hay varias maneras, incluyendo el uso de un nebulizador de gas de alta presión o un humidificador ultrasónico comercial, que convierten el agua a granel en un aerosol. Un método alternativo es dejar que el vapor de agua se condense en un sustrato muy frío. En la naturaleza, las ondas oceánicas y los procesos atmosféricos también generan microgotas de agua.
Algunos ejemplos de reacciones que las microgotas podrían modificar…
Aquí hay una lista de unos pocos informes que documentan las reacciones que parecen iniciar o acelerar las reacciones que las microgotas de agua parecen iniciar o acelerar. Algunos de ellos combinan microgotas con un catalizador tradicional, pero muchos se describen como libres de catalizadores. Richard Zare, de la Universidad de Standford, en los EE.UU., y sus colegas, están detrás de la mayoría de los estudios, pero no es el único equipo que investiga este intrigante fenómeno.
- Generación de peróxido de hidrógeno
- oxidación de metano
- Degradación de Hexadecán
- oxidación de ácido benzoico a fenol
- Aminación descarboxilativa de ácidos carboxilicos
- Reacciones de menshutkin
- Degradación de la víologen
- Alcismo cruzado oxidativo C-H/N-H
- Carbocaciones de Aryl de fenoles
- Convertir dióxido de carbono y nitrógeno en urea
- Convirtió nitrógeno en amoníaco
Es temprano, pero estos dos últimos ejemplos son probablemente los más emocionantes. Sugieren que las microgotas de agua podrían proporcionar una manera de sintetizar el amoníaco a temperaturas y presiones ambientales, lo que podría ayudar a los investigadores a desarrollar una alternativa sostenible al proceso de Haber-Bosch.
¿En qué se diferencian las microgotas del agua a granel?
Aparte de la diferencia de tamaño obvio, lo que distingue a las microgotas del grueso es que tienen una interfaz. Se considera ampliamente que el agua a granel sirve como un ambiente inerte para muchos sistemas químicos. En microgotas, sin embargo, la proporción de moléculas en la superficie de gotitas es mucho mayor en comparación con el agua a granel en un recipiente macroscópico, que altera las propiedades fisicoquímicas de agua.
Entonces, ¿cómo aceleran las microgotas de agua las reacciones químicas?
Esa es la pregunta del millón; hay varias teorías contradictorias, resultados experimentales y simulaciones computacionales en torno a los mecanismos por los cuales el agua microgotas acelera las reacciones.
La evaporación, que aumenta la concentración de reactivo, y el confinamiento podría explicar por qué las tasas de reacción en las reacciones bimoleculares se ven mejoradas por microgotas de agua, pero el mismo razonamiento se aplica a las reacciones unimoleculares. Por lo tanto, muchos atribuyen las velocidades de reacción aceleradas a los efectos en la superficie microdúpleta, incluyendo la resolución parcial, la orientación al reactivo, los extremos de la acidez superficial o la basicidad y grandes campos eléctricos. Podría ser una combinación de varios factores.
Se sabe que los campos eléctricos alteran las tasas de reacción y la selectividad, y a veces incluso los mecanismos de reacción. Una teoría es que las capas dobles eléctricas, la alineación de enlaces gratuitos de O-H en moléculas de agua interfacial o transferencia de carga parcial crea un campo eléctrico en la interfaz de agua del aire. Se cree que este campo eléctrico es lo suficientemente fuerte como para oxidarse los electrones de los iones de hidróxido u otras moléculas de cáscara cerrada disueltas en agua, formando radicales altamente reactivos y electrones libres.
¿Hay alguna otra teoría?
Sí. Uno de los informes más llamativo de fenómenos microgotas es que pueden formar espontáneamente peróxido de hidrógeno. Sin embargo, esa afirmación se discute y una reciente preimpresión atribuye este efecto particular a una interfaz diferente que entre microgotas de agua y un sólido. Aquí, se cree que el sólido oxidado el oxígeno disuelto en el agua para formar peróxido de hidrógeno. La preimpresión informa que la tendencia de los sustratos sólidos hacia la formación de peróxido de hidrógeno se relaciona con su potencial electroquímico, con magnesio generando más peróxido de hidrógeno que las obleas de silicio.
¿Por qué es tan difícil averiguar qué está pasando?
Es difícil diseñar experimentos de control para procesos multifásicos que aíslen el mecanismo exacto responsable de las velocidades de reacción aceleradas en los microdgotas de agua. El tamaño de la gota, la temperatura y la concentración son difíciles de mantener constantes. La cuantificación de especies de reacción a bajas concentraciones también es difícil y los sistemas también son sensibles a la contaminación. Además, las simulaciones que capturan fielmente aspectos importantes de la interfaz de agua del aire son computacionalmente exigentes.
¿Sería práctico ampliar una reacción usando microgotas?
Escalar las reacciones en las microgotas del agua podría ser difícil, si no económicamente poco competitivo con los procesos convencionales a gran escala, especialmente en lo que respecta a la energía eléctrica necesaria para crear neblinas de microgotas. Además, probablemente requieren volúmenes increíblemente grandes de disolvente. Un sistema que recicla y re-rocía el disolvente probablemente formará parte de cualquier reactor a gran escala que utilice microgotas de agua.
¿Podrían haber jugado las microgotas un papel en el origen de la vida?
Muchos expertos coinciden en que los procesos en la interfaz de agua del aire ayudaron a construir complejidad química. Por ejemplo, la investigación muestra que los aminoácidos abióticos fácilmente forman enlaces de amida en la interfaz de agua de aire de microgotas de agua. Dado este escenario condiciones imitadas que se cree ocurrieron en la Tierra primitiva, sugiere que los aerosoles atmosféricos o el spray marino podrían haber ayudado a iniciar la formación de los primeros biopolímeros.