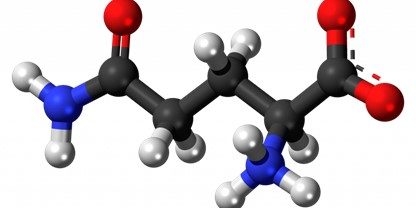
Antes de hablar de isomería, imaginemos, por un momento, que estamos en la mente de un niño repleto de curiosidad y creatividad. Tras mucho tiempo deseándolo, por fin podemos ir a esa tienda de juguetes que nos ha hecho sonreír en incontables ocasiones. Como no podía ser de otra forma, decidimos que la primera sección que queremos visitar es la de los juguetes relacionados con la construcción. Nuestros favoritos, esos en los que tenemos que utilizar numerosos bloques para lograr dar con nuestra propia creación. Imagina las posibilidades, ¿Cuántos de nosotros no hemos disfrutado de uno de estos juegos, pero terminábamos construyendo de todo menos lo que aparecía en la imagen de la caja?
Si en la mente de un niño abunda la diversidad creativa, en la naturaleza no iba a ser menos. Y es que, cuando decidimos observar la vida desde la menor de las escalas, nos damos cuenta de la inmensidad de moléculas distintas que habitan en nuestra realidad. Pero, ¿a qué viene el título? ¿Es que existen moléculas construidas con exactamente los mismos átomos que son distintas? ¿Qué consecuencias puede tener este fenómeno? ¿Influye de alguna forma en nuestra vida?
A todas estas cuestiones, daremos respuesta entendiendo primero el concepto de isomería.
Isomería, ¿Qué es?
El término isómero tiene un origen etimológico griego (isos=igual) y (meros=parte, porción). Así, la isomería es una propiedad que tienen aquellos compuestos con la misma fórmula molecular (C6H12O6, glucosa y fructosa), pero que difieren en su fórmula estructural. Por aclarar los términos, la fórmula molecular muestra qué y cuántos átomos forman la molécula. En cambio, cuando hablamos de fórmula estructural, nos referimos a la forma en que estos átomos se disponen en el espacio o se ordenan.
¿Qué tipos hay?
Ahora mismo sabemos qué es la isomería. Al principio, hablamos de la facilidad de encontrarnos, en términos generales, con una gran diversidad de moléculas en la naturaleza. Para comprender de una forma más visual en qué consisten los diferentes tipos de isómeros que podemos encontrar, es interesante emplear imágenes. Por evitar posibles sustos, aclararemos que, en las imágenes, cada letra se corresponde con un átomo. De esta forma, la simbología es la siguiente: C (carbono), H (hidrógeno), O (oxígeno). Además, también se aprecian unas líneas entre cada átomo, que no representan más que los enlaces entre cada uno de ellos, pudiendo ser simples, dobles o triples.
Como último inciso, y para poder hablar de estructuras, en química orgánica (conocida como química del carbono o de los seres vivos) las moléculas se componen, a grandes rasgos, de:
- Cadena hidrocarbonada: cadena de sucesivos átomos de carbono (C) que van acompañados de átomos de hidrógeno (H). De ahí el adjetivo hidrocarbonada.
- Grupo funcional: no es más que un determinado grupo de átomos que va a determinar las propiedades químicas más fundamentales de la molécula.
Isomería estructural.
Como su nombre indica, es aquella que presenta diferencias en la estructura del esqueleto hidrocarbonado. Asimismo, podemos hablar de isomería estructural de:
- Cadena: los compuestos con este tipo de isomería poseen el mismo grupo funcional, pero tienen una cadena con estructuras distintas. En la Imagen 1 aparece el caso del butano y el metilpropano. Ambos con 4 átomos de carbono y 10 de hidrógeno. No obstante, el butano tiene una cadena de cuatro carbonos de largo y el metilpropano de 3. La diferencia es que el metilpropano tiene un metilo (-CH3) en el centro. Por tanto, ambas cadenas son distintas; hablamos de isómeros de cadena.

Imagen 1. Isómeros de cadena. Autor de la imagen: Pablo Cruz Hornillo.
- Posición: estas moléculas tienen el mismo grupo funcional en diferentes posiciones. Para comprenderlo mejor, tenemos la Imagen 2. En ella se representan dos alcoholes distintos, pero parecidos. La diferencia reside en el carbono en que se encuentra el -OH del alcohol. En el propan-1-ol, se encuentra en el primer carbono, pero en el propan-2-ol está en el carbono del centro de la cadena (carbono 2).

Imagen 2. Isómeros de posición. Autor de la imagen: Pablo Cruz Hornillo.
- Función: en este caso hablamos de compuestos con distintos grupos funcionales. En el enlace de grupos funcionales que dejé en su apartado puedes ver una tabla con algunos ejemplos. Esta tabla arroja un detalle importante: hay distintos grupos funcionales con oxígeno o nitrógeno entre sus átomos. Esto permite que, en la Imagen 3, podamos ver dos moléculas con grupos distintos. El etanol es un alcohol, debido a su grupo hidroxilo (-OH). En cambio, el dimetiléter es un éter (R-O-R’). Los éteres se caracterizan por tener un oxígeno uniendo dos cadenas (representadas por la R). Por esto, ambos son isómeros de función.

Imagen 3. Isómeros de función. Autor de la imagen: Pablo Cruz Hornillo.
Estereoisomería.
A diferencia del grupo anterior, aquí las diferencias residen en el modo en que los átomos se distribuyen espacialmente.
- Geométrica: este tipo de isomería es exclusivo de los alquenos, es decir, aquellas moléculas con doble enlace C=C (ver Imagen 4). Los isómeros que distinguimos son los cis- y trans-, según nos encontremos ambos metilos (-CH3) en el mismo lado del doble enlace (cis-) u opuestos (trans-).

Imagen 4. Isomería geométrica. Isómeros cis- y trans-. Autor de la imagen: Pablo Cruz Hornillo.
- Óptica: aquí hablamos de un caso verdaderamente interesante. La isomería óptica, como se puede suponer, es característica de aquellos compuestos que presentan actividad óptica. ¿Y qué es esto de tener actividad óptica? Sencillamente hacemos referencia a la capacidad que tiene la sustancia en cuestión de desviar hacia la derecha o la izquierda un haz de luz en unas condiciones que veremos más adelante. Como ejemplo de compuesto ópticamente activo, propongo una molécula verdaderamente famosa, la glucosa (ver Imagen 5). Este compuesto no es más que un monosacárido (un tipo de azúcar) formado por 6 átomos de carbono que, como se ve en la misma imagen, tiene varios grupos hidroxilo (-OH) y un aldehído (-CHO). Además de por estos grupos funcionales, se caracteriza por servir de fuente de energía para numerosos seres vivos. Tan numerosos son estos seres, que entre ellos encontramos tanto humanos como bacterias. Ahora bien, ¿Qué son esos recuadros que aparecen en la Imagen 5? Quizás sea interesante ver esto en otro apartado.
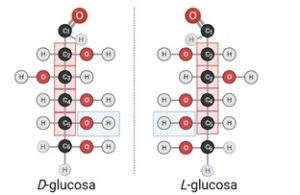
Imagen 5. Isomería óptica. Isómeros D y L de glucosa. En color rojo se representan los átomos de oxígeno (O), en negro los de carbono (C) y en blanco los de hidrógeno H. Los subíndices que hay en cada átomo de carbono tienen la no tan exótica finalidad de contarlos. Autor de la imagen: Pablo Cruz Hornillo, BioRender
El curioso caso de la isomería óptica.
Antes de hablar de esas curiosas figuras cuadradas, asegurémonos de comprender ciertas ideas básicas sobre la isomería óptica. Como puede ser que alguien haya observado, la D-glucosa y la L-glucosa son prácticamente iguales. Casi parece que la glucosa estuviera mirándose en un espejo. Esta idea es muy importante, y si aún puede pensarse que esta representación no es suficiente para saber que son moléculas distintas, pongamos un ejemplo.
No es la primera vez que se utiliza, pero no por ello es peor: podemos pensar en las manos que probablemente están manejando el dispositivo que se esté usando para leer este artículo. Si colocamos las manos con las palmas hacia arriba y ponemos una encima de la otra, evidentemente tenemos constancia de que no son exactamente la misma figura. Podemos decir, por lo tanto, que la mano derecha es imagen especular de la izquierda o viceversa. Esto es, el tipo imagen que se formaría cuando nosotros mismos, por ejemplo, nos miramos al espejo.
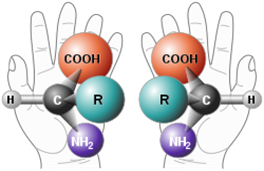
Imagen 6. Imagen especular de dos aminoácidos genéricos.
Fuente: https://commons.wikimedia.org/
Ahora pasemos al mundo molecular. Podemos hablar de imágenes especulares gracias a la presencia de carbonos quirales o asimétricos. Es ahora cuando hemos de mirar a los recuadros rojos de la Imagen 5. Si echamos un vistazo, vemos que solo están resaltados en rojo los carbonos del 2 al 5. ¿Qué pasa con el 1 y el 6?
La cuestión es que un carbono asimétrico es aquel que, de sus cuatro posibles enlaces, dedica cada uno a un grupo químico distinto. El carbono 1 tiene dos enlaces dedicados al oxígeno (O) y el 6 está unido a dos hidrógenos. Los demás, en cambio, se unen a grupos distintos. Pongamos por caso el carbono 4. Por arriba se une a un conjunto de 3 carbonos (con un grupo aldehído ó -CHO), por abajo se une a un conjunto con 2 carbonos, por un lateral se une a un -OH y, por el otro, solo a un hidrógeno. Por tanto, este carbono es asimétrico o quiral.
Ahora bien, sabemos qué confiere actividad óptica a una molécula. Pero, ¿Cómo distinguimos la D-glucosa de la L-glucosa? Esta información se transmite gracias al último grupo -OH (grupo hidroxilo) unido a carbono asimétrico. En este caso, el del carbono 5. En la serie D, se escribe a la derecha; pero, en la serie L, se escribe a la izquierda.
¿Cómo ver si hay actividad óptica?
Todo lo que he contado hasta ahora está muy bien. No obstante, desde una perspectiva experimental, ¿Cómo saber que hay desviación de la luz usando más que una fórmula en un papel? Antes de comenzar a explicar cómo podemos comprobarlo, puede resultar muy beneficioso hacer un pequeño inciso. La sustancia ópticamente activa desvía la luz polarizada. Es decir, que se mueve solo en un plano, así como un folio. Cuando el plano de luz se inclina hacia la derecha, la sustancia es dextrógira, y se representa con un signo positivo entre paréntesis, (+). En cambio, cuando la desviación es a la izquierda, hablamos de una molécula levógira (-).
Hay autores que hacen hincapié en que una sustancia de la serie D (como la D-glucosa), no necesariamente va a ser dextrógira. Se habla de nomenclatura D y L y, por separado, de levógiros y dextrógiros. Así, la única forma de saber en qué lado se desvía la luz sería acudiendo a datos experimentales.

Imagen 7. Esquema de un polarímetro. Fuente: https://commons.wikimedia.org/
Si observamos la Imagen 7, podemos ver un esquema que representa el funcionamiento básico de un polarímetro. Este es el equipamiento que se utiliza para medir cuántos grados se desvía el plano de luz polarizada. Entre paréntesis indicaremos con qué elemento de la imagen se corresponde cada componente de la explicación.
Una fuente de luz (1), como podría ser una lámpara de sodio, emite luz sin polarizar (2). Esta puede pasar por un filtro monocromador para trabajar solo con una longitud de onda o color (no está representado). Después, la luz pasa por un prisma de Nicol (3), que no es más que un filtro que emite luz polarizada (4).
Tras haber sido polarizada, la luz pasa por el recipiente (5) con la sustancia disuelta en un disolvente que sea adecuado (agua, etanol, etc.). Si la sustancia tiene actividad óptica, se emitirá el plano de luz girado (6) y el haz pasará por un segundo prisma de Nicol que sirve de medidor (7). Por último, un detector (8) recibe la señal y, así, se puede ver el resultado.
Importancia biológica.
Como no podía ser de otra forma, estas «pequeñas» diferencias entre algunas moléculas traen grandes consecuencias. Este hecho resalta con facilidad, por ejemplo, en el caso del etanol y el dimetiléter. Incluso a simple vista, la una no tiene nada que ver con la otra. No obstante, incluso en tipos de isomería como la óptica, las diferencias pueden ser muy notorias.
Se sabe que las distintas moléculas con actividad óptica que hay en la naturaleza no se reparten de forma azarosa. Es decir, no hay azúcares dextrógiros y levógiros en proporciones remotamente similares. Concretamente, en este caso de los glúcidos, abundan las formas D. Análogamente, como vimos en la Imagen 6, los aminoácidos también poseen quiralidad y, por tanto, actividad óptica. La cosa es que, a diferencia de los glúcidos, en la naturaleza predominan los aminoácidos de la serie L.
Ahora, ¿Qué pasaría si de repente se cambiaran las tornas? Lo cierto es que no podríamos dar una respuesta generalizada, válida para todas las moléculas pensables. No obstante, sí podemos afirmar que la funcionalidad cambiaría considerablemente. Esto se debe a que, en los organismos vivos, las enzimas (proteínas que aceleran reacciones químicas) tienen la capacidad de diferenciar entre enantiómeros (isómeros ópticos). Por esto, lo común es que solo uno de los enantiómeros pueda interaccionar con la enzima.
Por ilustrar un poco esta última información, podemos poner el caso de la epinefrina. En su forma levógira, es sintetizada por las glándulas adrenales. Si se diera la necesidad de suministrar epinefrina a un paciente, la forma dextrógira no sería funcional, e incluso sería ligeramente tóxica.
Conclusión.
A lo largo de este artículo hemos visto cómo las moléculas pueden ser mínimamente distintas a nuestros ojos. Esto no implica que los isómeros dejen de ser distintos y, por tanto, ciertas reacciones químicas puedan ocurrir o no según el isómero del que hablemos. Incluso hemos mencionado el leve nivel de toxicidad que puede tener la forma dextrógira de la epinefrina para el ser humano.
Ser un niño que observa dentro de su mente las posibilidades de combinatoria de las piezas de la construcción puede ser verdaderamente inspirador. Incluso, si se me permite, el simple hecho de viajar con la curiosidad de un niño, basta para impulsar el avance en el conocimiento.
Recomendamos:
- https://microbacterium.es/grafeno-el-material-del-futuro-en-el-presente
- https://microbacterium.es/quimica-una-historia-de-conocimiento
- https://www.quimicaysociedad.org/cinco-materiales-que-pueden-cambiar-el-mundo/
Este artículo ha sido redactado por el equipo de microbacterium.es de forma exclusiva para Foro Química Y Sociedad. Artículo redactado por Pablo Cruz Hornillo y editado por Rodrigo Álvarez Monzón
Referencias.
- Garric, M. P. (1979). Química general. Reverte.
- RAE-ASALE, & RAE. (s/f). isómero, isómera. Recuperado el 4 de mayo de 2021, de Rae.es website: https://dle.rae.es/is%C3%B3mero?m=form
- Hames, D., & Hooper, N. (2011). Biochemistry. Londres, Inglaterra: Garland Science.
- P. Y. Bruice, Fundamentos de Química Orgánica 3ªed., Pearson, 2015.